-
1 视频
-
2 章节测验

人类对于化学元素的定性分析,特别是定量分析进行了长期的实践。
根据道尔顿提出的原子观点,人们对元素有了新的认识,认为每一种元素都是由特定的原子组成的;不管这一种元素的数量多少,它都是由原子组成的。这种元素与另一种元素之所以不同,是因为它们的原子的性质不相同。一种原子与另一种原子的最基本的物理性质的区别,就是原子的重量不同。
1862年,法国地质学家坎古杜瓦首先提出了元素随着原子量的变化,其化学性质呈现周期性变化的问题。1864年德国化学家迈耶,按原子量递增顺序制定了一个“六元素表”。这个“六元素表”,1865年,英国化学家纽兰兹按原子量递增顺序,将已知元素作了排列。他发现,到了第八个元素就与第一个元素性质相似,亦即元素的排列每逢八就出现周期性。

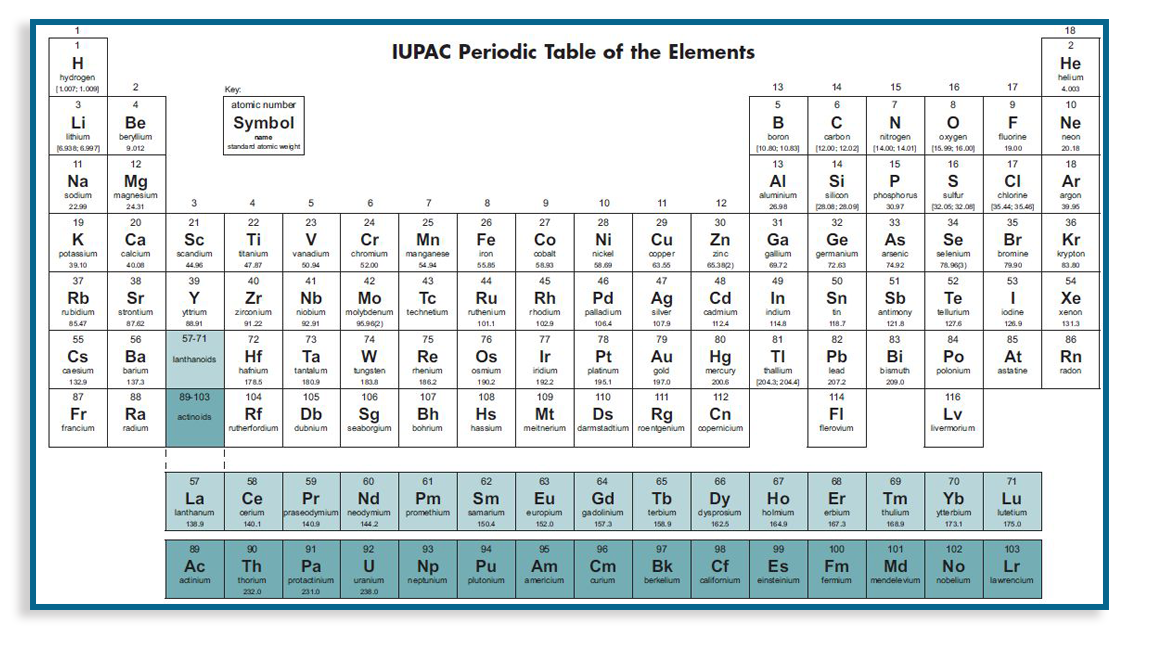
元素周期律(Periodic law),指元素的性质随着元素的原子序数(即原子核外电子数或核电荷数)的递增呈周期性变化的规律。周期律的发现是化学系统化过程中的一个重要里程碑。
19世纪60年代化学家已经发现了60多种元素,并积累了这些元素的原子量数据为寻找元素间的内在联系创造必要的条件。俄国著名化学家门捷列夫和德国化学
家迈锡尼等分别根据原子量的大小,将元素进行分类排队,发现元素性质随原子量的递增呈明显的周期变化的规律。1868年,门捷列夫经过多年的艰苦探索发现了自然界中一个极其重要的规律—元素周期规律。这个规律的发现是继原子-分子论之后,近代化学史上的又一座光彩夺目的里程碑它所蕴藏的丰富和深刻的内涵,对以后整个化学和自然科学的发展都具有普遍的指导意义。1869年门捷列夫提出第一张元素周期表,根据周期律修正了铟、铀、钍、铯等9种元素的原子量;他还预言了三种新元素及其特性并暂时取名为类铝、类硼、类硅,这就是1871年发现的镓、1880年发现的钪和1886年发现的锗。这些新元素的原子量、密度和物理化学性质都与门捷列夫的预言惊人相符,周期律的正确性由此得到了举世公认。


