![]() 本章归纳与整理
本章归纳与整理
1.有机化合物是指含碳元素的化合物,或碳氢化合物及其衍生物总称。有机化合物的主要性质特点是:大多数有机物在常温下为气体或液体、可燃(或易燃),易受热分解,水溶性差,反应复杂而缓慢。 判断未知物是否为有机物的常用的最简便的方法是燃烧法。
2.碳原子的结构特点:最外层电子数为4个,能以四个共价键与其它原子结合。
3.具有同一分子式,而结构不同的化合物,互称为同分异构体,这种现象称为同分异构现象;结构相似,分子式相差CH2或它的整数倍的化合物,彼此互称为同系物。同系物及同分异构是有机化学中非常普遍的现象。
4.有机化合物的命名有俗名、系统命名法和普通(习惯)命名法。其中,系统命名法很重要,各类化合物的命名都以烷烃的命名为基础。烷烃命名的十六字口诀为:最长碳链,最小定位,同基合并,由简到繁)。
5.只含碳和氢两种元素的化合物称为烃。烃是有机化合物中的一大类物质,包括烷烃、烯烃、炔烃及芳香烃等。
6.烷烃的分子通式为CnH2n+2, 化学性质稳定,甲烷易燃是瓦斯爆炸的主要成因。
7.烯烃的分子通式为CnH2n,因为有不饱和双键的存在,所以比烷烃活泼得多。可发生燃烧、加成(使溴水褪色)、氧化反应(酸性KMnO4溶液褪色)。
8.炔烃的分子通式为CnH2n-2, 具有与烯烃类似的性质。
9.芳香烃分子通式为CnH2n-6 (n≥6),苯(![]() )的分子结构决定其很难发生加成反应,而较易发生取代反应。取代反应包括卤代反应、硝化反应、磺化反应和酰化反应。烷基苯易被酸性高锰酸钾氧化,形成苯甲酸。
)的分子结构决定其很难发生加成反应,而较易发生取代反应。取代反应包括卤代反应、硝化反应、磺化反应和酰化反应。烷基苯易被酸性高锰酸钾氧化,形成苯甲酸。
10.醇ROH可与氧气及钠等活泼金属反应。在浓硫酸存在下,当加热温度不同时可发生分子内脱水形成烯或分子间脱水形成醚。醇还可与羧酸反应生成酯。甲醇、
乙醇等在有机物中属于极性较强的物质,常常用作溶剂。
11.苯酚![]() 具有弱酸性(比碳酸还要弱),比苯更易发生取代反应,取代的位置在OH基团的邻对位。它与溴水、三氯化铁的反应是其特征反应。
具有弱酸性(比碳酸还要弱),比苯更易发生取代反应,取代的位置在OH基团的邻对位。它与溴水、三氯化铁的反应是其特征反应。
12. 乙醚(CH3CH2OCH2CH3): 沸点低,极易挥发和着火,使用时要远离明火, 可用于外科手术的全身麻醉。醚与醇之间可以互为同分异构体。
13.醛![]() 和酮
和酮![]() 都有羰基,所以有一些相似的性质,如加氢的反应。但醛也有一些有别于酮的性质,包括银镜反应、与费林试剂(Fehling)反应等。40%的甲醛溶液是用于浸泡生物标本的福尔马林,丙酮是一种常用的溶剂。醛与酮之间可以互为同分异构体。
都有羰基,所以有一些相似的性质,如加氢的反应。但醛也有一些有别于酮的性质,包括银镜反应、与费林试剂(Fehling)反应等。40%的甲醛溶液是用于浸泡生物标本的福尔马林,丙酮是一种常用的溶剂。醛与酮之间可以互为同分异构体。
14.羧酸![]() 具有弱酸性,在浓硫酸催化下可与醇发生酯化反应。酯在无极酸或碱的作用下,可以水解成羧酸和醇。
具有弱酸性,在浓硫酸催化下可与醇发生酯化反应。酯在无极酸或碱的作用下,可以水解成羧酸和醇。
15. 胺RNH2(或R2NH,R3N)具有弱碱性,可与强酸(如盐酸)反应形成盐而增加其水溶性。苯胺![]() 可与溴水反应形成白色沉淀。尿素可以氢氧化钠作用产生氨气。
可与溴水反应形成白色沉淀。尿素可以氢氧化钠作用产生氨气。
16. 常见的简单杂环有五元杂环(如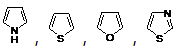 )、六元杂环(如
)、六元杂环(如![]() )及稠环(如
)及稠环(如![]() )等。杂环化合物在医药上有重要地位,很多重要的药物和生物体内发挥重要生理作用的物质都是杂环化合物。
)等。杂环化合物在医药上有重要地位,很多重要的药物和生物体内发挥重要生理作用的物质都是杂环化合物。
17. 蛋白质、糖、脂肪、核酸、维生素和矿物质等是维持人体正常生理活动的重要物质。


