实验一 熔点的测定
![]() 通过本次实验,你将会:
通过本次实验,你将会:
1.正确地选用和组装仪器及选择传热液。
2.掌握熔点测定的操作技术。
![]() 实 验 用 品
实 验 用 品
仪器:熔点测定管(b形管)、200℃温度计、铁架台、毛细管(内径0.9~1mm,长70~80mm)、酒精灯、烧瓶夹、牛角匙、玻璃管(内径lO mm左右,长20~750px)、软木塞、表面皿。
试剂:尿素、肉桂酸、导热液(液体石蜡)。
![]() 实 验 原 理
实 验 原 理
物质的熔点为物质在大气压力下固液两相平衡共存时的温度。当固态物质加热到一定温度时,将从固态转化为液态,此时的温度即为该物质的熔点。
每种晶体物质都有固定的熔点。纯晶体物质从始熔到全熔的温度差称为熔距或熔程,一般为0.5~1℃(除液晶外)。若含有少量杂质则熔点下降,熔程增大。所以通过测定晶体物质的熔点即可鉴定其纯度。大多数有机物的熔点在400℃以下,较容易测定。因此,在有机化学实验及研究工作中,常用操作简便的毛细管法测定熔点。
若样品是熔点相同或接近的两种晶体的混合物,可利用混合熔点测定法来检验它们是否为同一物质。若为同一物质,则熔点不变;若两种不同化合物的混合物,通常熔点都会下降,熔距增大。
![]() 实验内容及步骤
实验内容及步骤
1.传热液的选择
热浴所用的传热液,通常有浓硫酸、甘油、液体石蜡等。如温度在140℃以下,最好用液体石蜡或甘油。药用液体石蜡可加热到220℃仍不变色。在需要加热到140℃以上时,也可用浓硫酸。但热的浓硫酸具有极强的腐蚀性,如果加热不当,浓硫酸溅出时易伤人。温度超过250℃时,浓硫酸发生白烟,妨碍温度读数。在这种情况下,可在浓硫酸中加入硫酸钾,加热使成饱和溶液,然后进行测定。
本实验选用液体石蜡为传热液。
2.样品的填装
将毛细管一端在酒精灯火焰上加热封口。取绿豆大小的干燥样品,置于表面皿上研成粉末,并集中成堆。把毛细管开口一端插入其中,使少许样品进入毛细管管中。取一根玻管竖在表面皿上,把装有样品的毛细管 (封闭端朝下),从玻管口自由落下,这样反复几次,使样品紧密填在毛细管底部,直至高度达2~3mm。每个样品最好填装三根毛细管备用。
3.测定熔点的装置
如实验图1-1装好仪器。温度计插在缺口的软木塞中,水银球位于测定管的两侧管之间,传热液液面略高于测定管的侧管口,附在温度计下端的毛细管中的样品,位于温度计水银球侧面中部(见实验图1-2)。加热时酒精灯在熔点测定管的侧管末端缓缓加热,受热的液体因温度差而发生对流循环,使温度均匀。
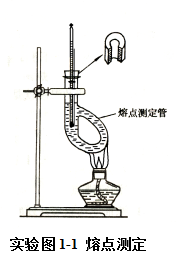
4.熔点的测定
每一个样品,至少要测定2次。第一次为粗测,加热可稍快,温度变化每分钟上升5~6℃,测得大约熔点范围。待传热温度降至熔点以下30℃左右时,换另一根装有样品的毛细管进行第二次精测。第二次测定时,开始温度可稍快(5℃/min),当温度低于熔点10~15℃时,调小火焰,使温度控制在每分钟升温1~2℃。一般在加热过程中,试将热源移去,观察温度是否上升,如停止加热,温度立即停止上升,说明加热速度是比较合适的。当接近熔点时,加热速度要更慢(0.2~0.3℃/min),此时应仔细观察温度计所示的温度与样品的变化情况。样品将依次出现“发毛、收缩、塌落(液滴)、澄清”等现象。当毛细管中样品开始出现小液滴时为“始熔”,全部样品变为澄清透明液体时为“全熔”。“始熔”到“全熔”的温度即为熔点,熔程=全熔温度-始熔温度。例如某样品124.0℃开始收缩,124.6℃塌落,有液滴出现,125.4℃时全部成为透明液体,应记录为:熔点124.6~125.4℃。一般纯净样品的熔程为0.5~l℃,若有少量杂质,则熔程增大。

![]() 实验视频
实验视频
![]() 实验任务
实验任务
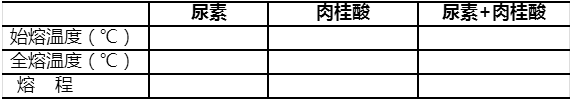
用毛细管法分别测定尿素、肉桂酸及尿素和肉桂酸(1∶1)混合物的熔点,注意比较三者的熔点及熔距变化。
表1-1 实验结果记录及处理
现在的实验室常用熔点仪进行自动测定,比如
![]() 思考与讨论
思考与讨论
1.样品为什么一定要研成粉末状?
2.加热快慢为什么会影响熔点?
3.纯物质的熔点和不纯物质的熔点有何区别?两种熔点相同的物质等量混合熔点有什么变化?


