实验三 粗食盐提纯
![]() 通过本次实验,你将会:
通过本次实验,你将会:
1.学习粗盐提纯的原理和方法。
2.掌握称量、加热、溶解、沉淀、过滤(常压过滤和减压过滤)、蒸发、浓缩、结晶和干燥等操作技术。
![]() 实验用品
实验用品
仪器:托盘天平、烧杯(100ml、250ml各1个)、玻璃棒、酒精灯、火柴、石棉网、剪刀、三脚架、漏斗、布氏漏斗、抽滤瓶、铁架台、铁夹、铁圈、药匙、坩埚钳、研钵、真空泵
试剂:粗食盐、1mol/LBaCl2 溶液、2mol/L HCl溶液、2mol/L NaOH溶液、饱和碳酸钠溶液、95%乙醇等。
其它:滤纸(直径225px、275px),pH试纸(pH=1~14)等。
![]() 实验原理
实验原理
化学试剂或医药用的氯化钠都是以粗食盐为原料提纯的。粗食盐中除含有少量不溶性杂质外,还含有K+、Ca2+、Mg2+、SO42-等离子。除去不溶性杂质,可用溶解和过滤方法;可溶性杂质Ca2+、Mg2+、SO42-等离子,-通常选用合适的试剂与其生成不溶性的化合物沉淀而除去,具体方法是首先在粗盐饱和溶液中加入BaCl2溶液,除去SO42-,然后再加入NaOH和Na2CO3溶液,除去Ca2+、Mg2+ 和过量的Ba2+。有关的离子方程式如下:
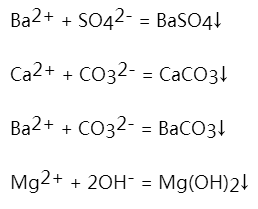
过量的NaOH和Na2CO3可用HCl中和后除去,粗盐中K+ 钾和上述沉淀剂不起作用,仍留在溶液中,由于KCl的溶解度比NaCl大,而且在粗食盐中含量极少,所以在浓缩NaCl溶液时,NaCl结晶出来,KCl仍留在溶液中,吸附在NaCl晶体上的HCl可用酒精洗涤而除去,再进一步用水浴加热,除去少量水、酒精和HCl,最后得到纯度很高的NaCl。
![]() 实验操作步骤
实验操作步骤
1.称量和溶解:在托盘天平上称取6.0g粗盐,置于小烧杯中,加30mL水,加热并搅拌使其溶解。用普通漏斗过滤,除去不溶性杂质,保留溶液。
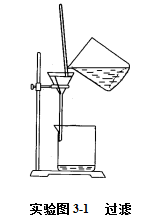
2.除去SO42- 离子:将粗食盐溶液加热至近沸,边搅拌边逐滴加1mol/LBaCl2溶液2~3mL,继续加热5分钟,使沉淀颗粒长大而易于沉降。待沉淀下降后在上层清液中,加入1~2滴1mol/L BaCl2溶液,观察是否有浑浊现象,若发生浑浊,表明SO42- 未除尽,需继续加1mol/L BaCl2使SO42-沉淀完全,若无浑浊,说明SO42- 已沉淀完全,将溶液进行常压法过滤(如图3-1)。
3.除去Ca2+、Mg2+和过量的Ba2+等离子:将所得滤液加热至近沸,边搅拌边加入1mL 2mol/LNaOH溶液和2 mL饱和Na2CO3溶液,加热至沸。待沉淀沉降后,在上层清液中加入Na2CO3溶液至不在浑浊为止,静置片刻,用普通漏斗过滤。
4.调节溶液的pH值:在滤液中逐滴加2mol/L HCl 溶液,充分搅拌,并用玻璃棒蘸取滤液在pH试纸上试验,直到溶液pH值为3~4为止。
5.蒸发浓缩:将滤液转移到蒸发皿中,用小火加热,不断搅拌(如图4-2),蒸发浓缩至溶液呈稀粥状为止,停止加热(切勿蒸干)。

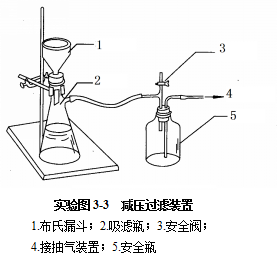
6.结晶、减压过滤、干燥:冷却析出结晶后,用布氏漏斗减压抽滤至干(如图4-3),将K+等杂质离子除去,再用少量95%乙醇淋洗产品2~3次。将结晶转移到蒸发皿中,在石棉网上用小火加热干燥(不冒水气,呈粉状,无劈啪响声)。冷却后,称重,计算产率。
实验任务
称取6.0g粗食盐进行提纯。
数据记录与结果处理:
在托盘天平上称取粗食盐m= g,提纯后食盐m= g。

![]() 思考与讨论
思考与讨论
1.过滤操作时如何做到:“一贴”、“二低”、“三靠”?
2. 蒸发时为什么一定要搅拌?
3.样组装和拆卸抽滤装置?


