实验七 天平的使用
![]() 通过本次实验,你将会:
通过本次实验,你将会:
1.知道常用的天平。
2.能使用托盘天平、电子天平。
3.学会直接称量法和减重法。
天平是进行化学实验不可缺少的重要的称量仪器。在各种不同的化学实验中,由于对质量准确度的要求不同。需要使用不同类型的天平进行称量。常用的天平种类很多,如托盘天平、电子天平、工业天平、电光分析天平等。本实验重点学习托盘天平和电子天平的使用。
![]() 托盘天平的使用
托盘天平的使用

托盘天平(又叫台秤)常用于一般称量。它的特点是操作简便迅速,但称量精确度不高。最大载荷为200g托盘天平称准至0.2g。
托盘天平的构造如图8-1所示。
托盘天平的基本操作步骤:
(1)调零点
在称量物体之前,先调整托盘天平的零点。将游码拨到游码标尺的“0”位处,检查托盘天平的指针是否停在刻度盘的中间位置。如不在中间位置,通过调节托盘下侧的平衡调节螺丝,使指针在刻度盘左右摆动大致相等,最后停在刻度盘的中间位置(此中间位置称为零点)。
(2)称量
左盘放称量物,右盘放砝码。砝码用镊子夹取,10g或5g以下的质量,可移动游码标尺上的游码。当添加砝码到托盘天平的指针停在刻度盘中间位置时,托盘天平处于平衡状态。此时,砝码加游码的读数即为物体的质量。
(3)记录

![]() 电子天平的使用
电子天平的使用
电子天平一般有自动调零,自动校准,自动去皮和自动显示称量结果,打印结果等功能。与普通的分析天平相比,电子天平达到平衡时间短,称量快速。电子天平的称量度不完全相同,精度高的电子天平均有玻璃罩,使用时要开启玻璃罩门。

下面以AUY120型电子天平为例,简要说明电子天平的使用步骤。

1.检查并清洁天平,接通电源
2.按“ON”键,显示屏显示“0.0000g”。预热半小时。
3.称重。称量前显示屏如果显示不是“0.0000g”,按“TAR”键清零。将被称物轻轻放在称盘上,待显示屏上的数字稳定后,读数并记录称量结果。
如果被称物需放入一定的容器内(如烧杯)称,则应先将装被称物的容器放入电子天平内先称重,待天平平衡后按“TAR”键“去皮”,再将被称物放入容器内称量,平衡后显示屏显示的数值即为被称物的质量。

![]() 称量方法介绍
称量方法介绍
根据不同的称量对象和不同的天平,在实验中可采用不同的称量方法和操作步骤,常用的称量方法有:
(1)直接称量法:天平调节零点后,将称量物置于天平盘中央,按从大到小的顺序加减砝码,天平达到平衡后所得读数即为称量物质量。
(2)固定质量称量法:先按直接称量法称取盛放试样的空容器质量,在已有砝码的质量上再加上欲称取试样质量的砝码,将试样慢慢加入容器直至天平达到平衡。
(3)递减称量法(减重法):一般称取试样或基准试剂时采用减量法。称出试样质量没有固定要求,只要在规定的范围即可。操作方法如下:
将适量的试样装入干燥洁净的称量瓶中,用洁净的小纸条套在称量瓶上,将称量瓶放在天平盘上称其质量,取出称量瓶,在接收试样的容器上方取下瓶盖,慢慢将称量瓶向下倾斜,用瓶盖轻敲瓶口,使试样落入容器中,接近所需重量时,用瓶盖轻敲瓶口,使粘在瓶口的试样落下,同时将称量瓶慢慢直立并回敲,然后盖好瓶盖,再称称量瓶质量。两次质量之差就是倒入容器中的第一份试样的质量,如果试样倒得过少,可以按上述操作补加后再准确称量。同法可连续多次称取。

![]() 实验任务
实验任务
1.托盘天平称重练习
(1)称取100mL的烧杯重量。
(2)称取1.0g NaCl。
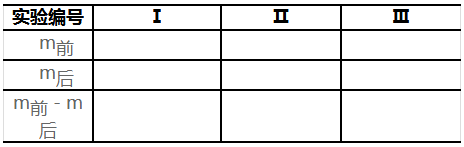
(3)采用减重法准确称取0.15g的无水碳酸钠三份,完成表7-1。
实验表7-1 无水碳酸钠称量数据记录

![]() 思考与讨论
思考与讨论
1.根据本次实验,观察托盘天平和电子天平分别读到小数点后几位?
2.在减重法称量中,如果有无水碳酸钠在敲击中洒落在接收容器外,会出现什么结果,为什么?


