实验八 溶液的配制
![]() 通过本次实验,你将会:
通过本次实验,你将会:
1.能正确洗涤容量仪器
2.能正确使用容量仪器
3.能按要求配制溶液
![]() 实验用品
实验用品
仪器:烧杯,容量瓶,移液管,量筒,试剂瓶,托盘天平
试剂:氯化钠,95%乙醇,EDTA,
玻璃仪器的洗涤
在分析工作中,玻璃仪器的洗涤是一项必须做的实验前的准备工作,带有很强的技术性。仪器洗涤是否符合要求,对检验结果的准确和精密度均有影响。
玻璃仪器洗涤中常用的洗涤剂有肥皂,洗衣粉,去污粉,洗液,有机溶剂等。
洗刷仪器时,应先用肥皂将手洗净,再按要求选用洗涤剂洗刷或洗涤。一般先用自来水洗3~6次,再用纯化水冲三次以上,用纯化水冲洗时,应顺壁冲洗并充分震荡。洗净的玻璃仪器,以不挂水珠为度。如仍能挂住水珠,则需要重新洗涤。洗净的仪器用指示剂检查应为中性。
玻璃仪器在每次实验完毕后应洗净干燥备用。可采用晾干、烘干、热(冷)风吹干等方法进行干燥,容量仪器不能烘干。对急于干燥的仪器或不宜烘干的仪器可用吹干的办法,即用少量乙醇、丙酮(或最后再用乙醚)倒入已控去水分的仪器中摇洗,然后用电吹风机吹,先用冷风吹至大部分溶剂挥发后吹入热风至完全干燥,再用冷风吹去残余蒸汽,不使其冷凝在容器内。
容量瓶的使用
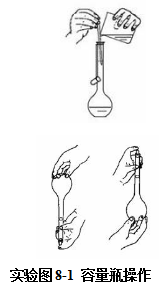
(1)容量瓶检漏
将容量瓶装满水,盖紧瓶塞,右手食指抵住瓶塞,大拇指和中指捏住瓶颈,左手食指、大拇指和中指指尖握住瓶底,将容量瓶倒置片刻,观察瓶塞周围有无漏水现象。如不漏水,就可以使用了。
(2)洗涤
按玻璃仪器的常规洗涤方法操作。
(3)溶液配制
先将称好的固体物质放入干净的烧杯中用少量蒸馏水溶解。其次,将杯中的溶液沿玻璃棒小心地转移到容量瓶中,再从洗瓶中挤出少量水淋洗烧杯和玻璃棒2~3次,并将每次的淋洗液注入容量瓶中。然后加蒸馏水至标线处(加水操作要小心,切勿超过标线)。塞好瓶塞,倒转容量瓶多次,并在倒转时加以摇动(待气泡上升至底部,再倒转过来,使气泡上升到顶部,如此反复),使溶液充分混合均匀。如用浓溶液配制稀溶液,一般先用少量蒸馏水在烧杯中稀释,再转移至容量瓶中,最后配成一定体积的稀溶液。
吸管(移液管)的使用
吸管又称为移液管,是准确量取一定体积液体的仪器。管上刻有容积和测定体积的温度。使用前,依次用洗涤剂、自来水和纯化水洗至不挂水珠,最后用少量待吸液润洗2~3次(深入待吸液时应先用吸水纸将移液管外壁拭干)。
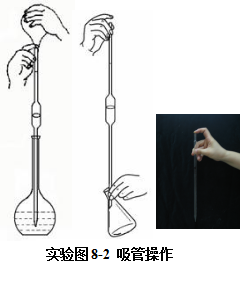
吸取溶液时,右手拿移液管,使吸管下端深入溶液液面下约1厘米处,切不可太深或太浅(为什么?)。左手拿洗耳球并将球内空气压出,将球的尖端深入移液管顶口,慢慢松开洗耳球,使溶液吸入管内,当液面在吸管标线以上时,迅速用右手食指紧按管口,将吸管尖嘴离开液面,靠在容器壁上,稍微放松食指,液体慢慢流出,待其液面下降至与标线相切时,立即按紧食指,液体停止流出。将移液管移入准备承接溶液的容器中(容器应略倾斜,移液管保持垂直),使管尖与容器内壁接触,松开食指使溶液自然下流,全部流完静待15秒钟左右,取出移液管(尖端残留液体不能吹出,如果移液管上有“吹”字,则必须用洗耳球将尖端残留液体吹入容器内)。
![]() 实验任务
实验任务
1.用自来水反复练习吸管的操作。
2.配制100mL75%消毒酒精。
3.配制100mL 9%的氯化钠溶液。
4.配制100.00mL0.0500mol/L草酸标准溶液(留作酸碱滴定实验用)。

![]() 思考与讨论
思考与讨论
1.常用容量仪器有哪些?分别有什么特点? 如何使用?
2.固体试剂配溶液的一般步骤是什么?液体试剂配溶液的一般步骤又是什么?


