实验九 滴 定 操 作
![]() 通过本次实验,你将会:
通过本次实验,你将会:
1.掌握滴定管的使用方法。
2.知道酸碱滴定原理及操作。
![]() 复习与讨论
复习与讨论
盐酸的基本性质
结论:
由于盐酸容易挥发,不能用直接法配制,因此,配制HCl标准溶液时,只能先配制成近似浓度的溶液。用什么方法可以确定所配制的盐酸溶液的准确浓度(标定)呢?
标定方法
1.基准物质标定溶液的准确浓度。
2.用另一已知准确浓度的标准溶液滴定该溶液。
![]() 滴定管的使用
滴定管的使用
滴定管主要用于定量分析作滴定用,有时也能用于精确取液。滴定管分酸式和碱式两种。
1.用前检查
滴定管在使用前要检查是否漏水,旋塞转动是否灵活。碱式滴定管漏水,需更换玻璃球或橡皮管;酸式滴定管漏水或旋塞转动不灵活,需涂凡士林。具体方法如下:
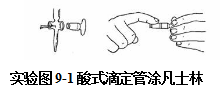
取出旋塞,洗净,擦干,在塞子大小两端各涂少许凡士林,然后,将旋塞对准旋塞槽中央一直插入槽内,插时旋塞应与旋塞槽平行,以免涂在旋塞上的凡士林扎堆粘在旋塞槽某处。接着,向同一方向旋转旋塞,直至活,旋塞转动部分看起来透明即可。最后用橡皮圈套住活塞末端,以防活塞脱落。

2.洗涤
洗涤时可先用自来水冲洗,再用纯化水洗涤2~3次,最后用待装溶液润洗2~3次。洗净的滴定管,管壁应不挂水珠。滴定管的洗涤方法如下:
用洗洁精(或洗液)洗碱式滴定管时,先取一定量的稀释的洗洁精(或洗液)倒入烧杯中,碱式滴定管中的玻璃珠取出后,倒置在烧杯中,将洗洁精(或洗液)吸入滴定管中(如何操作?洗液能否浸泡橡皮管?)后,用弹簧夹夹住橡皮管,静置几分钟。最后,松开弹簧夹,使洗洁精(或洗液)流回烧杯中,回收。对于酸式滴定管,直接装入洗洁精(或洗液)浸润滴定管,静置几分钟后,分别从上下口放出洗洁精(或洗液)。然后,用自来水冲洗干净,此时滴定管内壁应不挂水珠。再用蒸馏水洗2~3次,最后,用待装液润洗2~3次。
3.装液
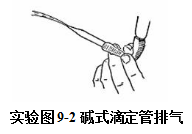
装溶液时,应关闭旋塞。直接从试剂瓶倒入滴定管中(不能转经其它容器,以免带来污染),到“0”刻度线以上。开启旋塞(滴定管稍微倾斜)或挤压玻璃球(橡皮管稍向上弯曲),驱逐出滴定管下端的气泡。

4.滴定
将滴定管夹在滴定管夹子上,必须保持垂直,否则读数不准。用右手持锥形瓶颈部。使用酸式滴定管时,左手的大拇指、食指和中指转动旋塞,使酸液逐滴滴入锥形瓶内,同时右手不断摇动锥形瓶,以使溶液混合均匀。使用碱式滴定管时,用左手挤压橡皮管内玻璃球使碱液逐滴滴入瓶中。
5.读数
读数不准确是酸碱滴定误差的主要来源之一。读数时视线应与液面保持水平,读取与弯月面相切的刻度。在对浅色或无色溶液读数时,可在管的背后衬一张白色硬卡纸以帮助读数。读取数字应估计到小数点后第二位数。每次滴定有“始读数”(即滴定开始时的溶液体积)和“终读数”(即滴定结束时的溶液体积)。
![]() 实验原理
实验原理
酸碱中和滴定反应的实质是:H+ + OH- =H2O
当反应到达终点时,根据酸给出H+的物质的量与碱接受H+的物质的量相等的原则,可求出酸或碱的物质的量浓度。
即:
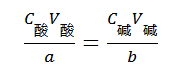
C酸、C碱:分别代表酸和碱的物质的量浓度
V酸、V碱:分别代表酸和碱的体积
a、b:反应式中有关物质(酸,碱)的化学计量系数,它们可由具体反应式来决定。
根据上述公式,如果取一定量已知浓度的酸(或碱),可以确定另一碱(或酸)溶液的浓度。
中和反应的滴定终点借助指示剂的颜色变化来确定。一般强碱滴定强酸,或强碱滴定弱酸时,常以酚酞为指示剂;而强酸滴定弱酸时,常以甲基橙为指示剂。
![]() 思考与练习
思考与练习
1.盐酸和氢氧化钠反应的a,b分别是多少?
2.草酸(H2C2O4)和氢氧化钠生成草酸钠(Na2C2O4)反应的a,b值分别是多少?
![]() 实验任务
实验任务
1.氢氧化钠溶液浓度的标定
用草酸标准溶液标定氢氧化钠溶液的浓度。
(1)在用NaOH溶液润洗过的碱式滴定管中,注入NaOH溶液到“0”刻度以上,逐出橡皮管和尖嘴内的气泡,并将液面调至“0.00”刻度(或稍低)处。记录其始读数。
(2)用已用标准草酸溶液润洗过的吸管 ,吸取25.00mL标准草酸溶液加到洁净的雏形瓶中,再加2~3滴酚酞指示剂,摇匀。
(3)把滴定管中的NaOH溶液逐滴滴入瓶内。滴定刚开始时,液体滴出的速度可稍快一些。但只能一滴一滴地加,不可形成一股水流。碱液滴入酸中时,局部会出现粉红色,随后摇动,粉红色很快消失。如不慎将滴定液滴到锥形瓶内壁上,及时用蒸馏水冲洗瓶壁,确保其全部落入混合液中。当滴定接近终点时,粉红色消失较慢。此时每加一滴碱液都要将溶液摇动均匀。观察粉红色是否消失。最后应控制液滴悬而不落,用锥形瓶内壁把液滴沾下来(这时加入的是半滴碱液),用洗瓶冲洗锥形瓶内壁,摇匀,放置半分钟后,粉红色不消失,则认为已达终点,记下滴定管液面的位置。
(4)重复滴定一次。三次所用NaOH溶液的体积相差不超过0.05~0.10mL时,即可取平均值计算NaOH溶液的浓度。
2.盐酸溶液浓度的测定
用已测知浓度的碱液测定盐酸溶液的浓度。
(1)在用该盐酸润洗过的酸式滴定管中注入盐酸溶液,逐出尖嘴内的气泡,调节液面至“0.00”刻度(或稍低)位置。记录盐酸的初始体积。
(2)用经已标定的NaOH溶液润洗过的移液管,吸取25.00mL已标定的NaOH溶液,放入洁净的锥形瓶中,加2滴甲基橙指示剂。
(3)酸液逐滴加入瓶内,不断摇动锥形瓶。当瓶内溶液颜色恰好由黄色变成橙色时,即达滴定的终点,记录终读数。
(4)重复滴定两次。三次所用酸液体积相差不超过0.05~0.10mL时,即可取平均值计算盐酸溶液的浓度。
3.数据记录和处理
(1)标准草酸溶液(实验6中配的)浓度 mol·L-1
(2)NaOH溶液浓度的标定(实验表9-1):
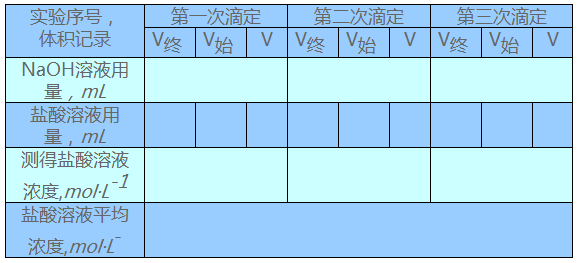
(3)盐酸溶液浓度的测定(实验表9-2)
实验表9-1氢氧化钠溶液浓度的标定
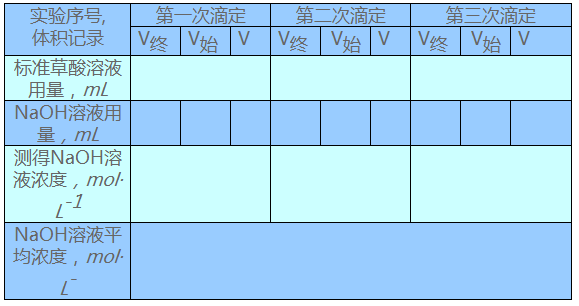
实验表9-2盐酸溶液浓度的测定
![]() 思考与讨论
思考与讨论
1.用于标定的基准物质应具备什么条件?用已失去部分结晶水的草酸配制溶液时,对溶液浓度的精确度有无影响?
2.本实验中所使用的玻璃仪器要烘干吗?为什么?锥形瓶是否也应该用所盛溶液润洗?为什么?
3.滴定过程中,锥形瓶内壁的上部溅有滴定液,对滴定结果有何影响?
4.滴定完后,滴定管尖嘴内有气泡,对滴定结果有何影响?
5.如何进行半滴操作?滴定完后,滴定管尖嘴外留有液滴,对滴定结果有何影响?
6.读数时视线仰视,会导致测定结果偏大还是偏小?为什么?
7.滴定管体积的初、终读数可以分别由两人来读吗?为什么?
8.滴定管水洗后如果不用待装液洗涤,会出现什么问题?为什么?


