实验十 分馏
 通过本次实验,你将会:
通过本次实验,你将会:
1.了解分馏法分离提纯物质的原理。
2.知道简单分馏装置的组装和拆卸。
3.学会使用分馏装置分离物质。
![]() 实验用品
实验用品
仪器:圆底烧瓶、茄形瓶、刺型分馏柱、冷凝管、温度计、尾接管、酒精灯、石棉网、铁架台、铁圈、十字夹、铁夹、升降台、橡皮塞、橡皮管。
试剂:60%酒精溶液。
其它:沸石、火柴。
![]() 实验原理
实验原理
蒸馏和分馏是分离、提纯有机化合物最重要最常用的方法之一。应用分馏柱将几种沸点相近(沸点差值小于30℃)的混合物进行分离的方法称为分馏,它在化学工业和实验室中被广泛应用。
分馏法分离混合物的原理与蒸馏相同,实际上分馏就是在分馏柱内对混合物进行多次蒸馏。沸腾的混合物蒸汽通过分馏柱,在柱内蒸汽中高沸点组分被柱外冷空气冷凝变成液体,回流烧瓶中,使继续上升的蒸汽中低沸点组分含量相对增加,冷凝液在回流途中与上升的蒸汽进行热量与质量的交换,上升的蒸汽中,高沸点组分又被冷凝下来,低沸点组分继续上升,在柱中如此反复的气化、冷凝。当分馏柱效率足够高时,首先从柱上面出来的是纯度较高的低沸点组分,随着温度的升高,后蒸出来的是高沸点组分,留在蒸馏烧瓶的是一些不易挥发的物质。
在本次实验中,要分离的是约60%的乙醇水溶液。我们要收集的馏分是蒸汽温度78℃,此馏分中乙醇的质量百分比浓度(The mass concentration)将达到90%左右。残留物主要是水,可弃去。
![]() 实验装置
实验装置
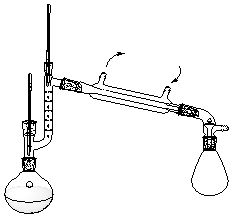
实验图10-1 分馏装置
实验任务及操作步骤
1.将100mL浓度约为60%的乙醇水溶液倒入250mL的圆底烧瓶中,加入两粒沸石(Zeolite),安装好分馏装置,分馏柱应缠紧石棉绳(为什么?)。注意:装置应该稳定、不倾斜、气密性好。
2.打开冷凝水,用加热锅加热圆底烧瓶(也可以用水浴加热),至瓶内溶液沸腾,蒸汽慢慢升入分馏柱。此时要严格控制加热温度,使蒸汽慢慢上升至柱顶。
3.当蒸汽温度为78℃时,收集馏分。若之前已有馏分,此时应该换用接收器。保持馏出液的滴下速度为每秒1~2滴。
4.外界条件不变的条件下,当温度持续下降时,停止加热,所得馏出液应该为约50~60mL。
5.用酒精比重计测定馏出液的质量百分比浓度。

![]() 思考与讨论
思考与讨论
1.什么叫沸点?液体的沸点和大气压有什么关系?
2.分馏和蒸馏在原理及装置上有哪些异同?如果是两种沸点很接近的液体组成的混合物能否用分馏来提纯呢?
3.若加热太快,馏出液>1-2滴/秒(每秒种的滴数超过要求量),用分馏分离两种液体的能力会显著下降,为什么?
4.用分馏柱提纯液体时,为了取得较好的分离效果,为什么分馏柱必须保持回流液?
5.在分离两种沸点相近的液体时,为什么装有填料的分馏柱比不装填料的效率高?
6.什么叫共沸物?为什么不能用分馏法分离共沸混合物?


