-
1 内容
-
2 练习
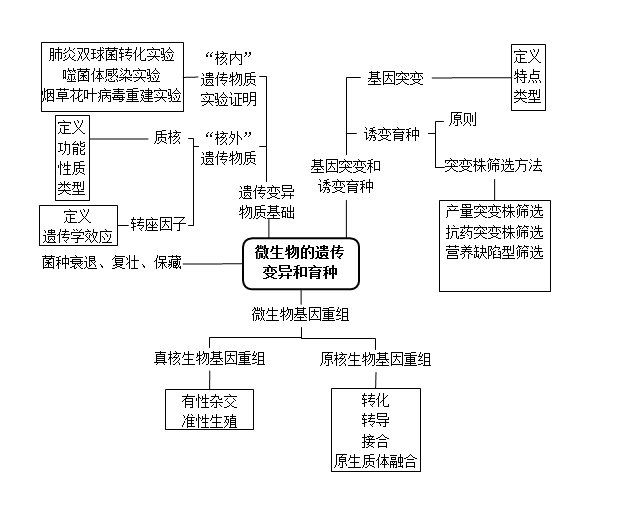
知识结构图
内容
三个经典实验-----“核内”遗传物质证明实验
肺炎链球菌的转化实验
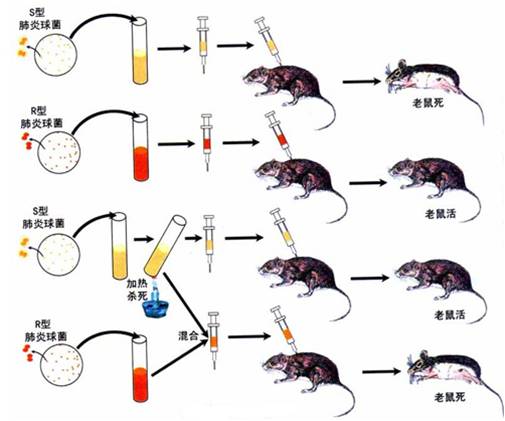
1928年英国医生F.Griffith首次发现转化现象。少量的R型与大量加热杀死的S型细胞混合注射到小白 鼠体中,白鼠病死,在其尸体内发现有活的S型细胞。此实验说明,加热杀死的S型细菌,在其细胞内可能存在一种转化物质,它能通过某种方式进入R型细胞,并使R型细胞获得稳定的遗传性状。
1944年,Avery等人从热死的S型S.pneumoniae中提纯了可能作为转化因子的各种成分,并在离体条件下进行了转化实验。
从活的S菌中抽提各种细胞成分 DNA,RNA,蛋白质,荚膜多糖等。并对各组分进行转化试验。

结果表明,只有S型细菌的DNA才能将S.pneumoniae的R型转化为S型。而且DNA纯度越高,转化效率也越高。只取微量纯DNA(6×10-8g),仍有转化能力。这就说明S型菌株转移给R型菌株的,决不是某一遗传性状(如荚膜多糖)本身,而是以DNA为物质基础的遗传因子。
噬菌体的感染实验

1952年A.D.Hershey和M.Chase将E.coli培养在以放射性32PO43-或35SO42-作为磷源或硫源的合成培养基中。结果,可以获得含32P-DNA(噬菌体核心)的噬菌体或含35S-蛋白质(噬菌体外壳)的两种实验用噬菌体,在噬菌体的感染过程中,其蛋白质外壳未进入宿主细胞 。进入宿主细胞的DNA经增殖、装配后,能产生一大群既有DNA核心又有蛋白质外壳的完整噬菌体颗粒。这就有力地证明在其DNA中,含有包括合成蛋白质外壳在内的整套遗传信息。通过电子显微镜的观察也证实了这个论点。
烟草花叶病毒的重建实验
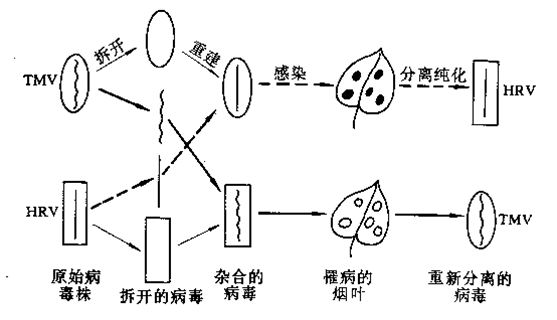
H.Fraenkel-Conrat(1956年)用含RNA的烟草花叶病毒进行了著名的植物病毒重建实验。把TMV放在一定浓度的苯酚溶液中振荡,就能将它的蛋白质外壳与RNA核相分离。分离后的RNA在没有蛋白质包裹的情况下,也能感染烟草并使其患典型症状,而且在病斑中还能分离出正常病毒粒子。但由于RNA是裸露的,所以感染频率较低。在实验中,还选用了另一株与TMV近缘的霍氏车前花叶病(HRV,Holmes ribgrass mosaic virus)。
当用TMV的RNA与HRV的蛋白质外壳重建后的杂合病毒去感染烟草时, 烟叶上出现的是典型的TMV病斑,从中分离出来的新病毒也是典型的TMV病毒。反之,用HRV的RNA与 TMV的蛋白质外壳进行重建时,也可获得相同的结论。这就充分说明,核酸(这里为RNA)是病毒 的遗传物质。
三个经典实验有力证明:只有核酸才是贮存遗传信息的真正物质。
案例
细菌质粒DNA的微量制备
质粒(Plasmid)是一种双链的共价闭环状的DNA分子,是染色体外能够稳定遗传的因子。质粒具有复制和控制机构,能够在细胞质中独立自主的进行自身复制,并使子代细胞保持它们恒定的拷贝数。从细胞生存来看,没有质粒存在,基本上不妨碍细胞的存活,因此质粒是寄生型的自主复制子。
大肠杆菌染色体DNA比通常用作载体的质粒DNA分子大得多,在提取得过程中,染色体DNA易断裂成线性DNA分子,而大多数质粒DNA则是共价闭环型,根据这一差异便可以设计出各种分离、提纯质粒DNA的方法。
在EDTA存在的条件下,用溶菌酶破坏细菌细胞壁,同时经过NaOH和阴离子去污剂SDS处理,使细胞膜崩解,从而达到菌体充分的裂解。此时,细菌染色体DNA缠绕附着在细胞膜碎片上,离心时易被沉淀出来。而质粒DNA则留在上清液内,其中还含有可溶性蛋白质、核糖核蛋白和少量染色体DNA,实验中加入蛋白质水解酶和核糖核酸酶,可以使它们分解,通过碱性酚(pH8.0)和氯仿-异戊醇混合液的抽提可以除去蛋白质等等。异戊醇的作用是降低表面张力,可以减少抽提过程中产生的泡沫,并能使离心后水层、变性蛋白层和有机层维持稳定。含有质粒DNA的上清液用乙醇或异丙醇沉淀,获得质粒DNA。
由于细菌裂解后受到剪切力或核酸降解酶的作用,染色体DNA容易被切断成为各种大小不同的碎片而与质粒DNA共同存在,因此,采用乙醇沉淀法得到的DNA除含有质粒DNA外,还可能有少部分染色体DNA和RNA,必要时可进一步纯化。
准备:LB 液体培养基、TEG缓冲液(溶液I)、碱裂解液(溶液II)、乙酸钾溶液(溶液III)、酚/氯仿(1:1)溶液配制、无水乙醇及70%乙醇、TE缓冲液(10mmol/L, pH8.0 Tris-HCl, 1mmol/L EDTA)、携带质粒的大肠杆菌、Eppendorf管、恒温振荡器、台式离心机等
方法:
1)培养细菌扩增质粒
将携带质粒的大肠杆菌接种于含适当抗生素的LB液体培养基中,37℃摇床培养过夜。
2)收集菌体和裂解细菌
(1)取1.5mL培养液置Eppendorf管内,离心,5000r/min,5min,弃去上清,保留菌体沉淀。如菌量不足可再加入培养液,重复离心,收集菌体。
(2)将菌体沉淀悬浮于预冷的100μl溶液I,剧烈振荡、混匀,室温放置10min。
(3)加入200μl新鲜配制的溶液II,加盖,颠倒数次轻轻混匀,放置5min。
3)分离纯化质粒DNA
(1)加入150μl冷却的溶液III。加盖后,温和颠倒数次混匀,放置15min。
(2)4℃下离心,5000r/min, 5min,乙酸钾能沉淀SDS与蛋白质的复合物,并使过量的SDS-Na+转化为溶解度很低的SDS-K+一起沉淀下来。离心后,上清液若仍混浊,应混匀后再冷至0℃,重复离心。上清液转移至另一干净的Eppendorf管内。
(3)加入等体积的酚,反复振荡,离心,12000r/min, 5min, 小心吸取上层水相溶液,转移到另一个Eppendorf管中。
(4)加入等体积24:1的氯仿/异戊醇混合液,反复振荡,离心,12000r/min, 5min, 小心吸取上层水相溶液,转移到另一个Eppendorf管中
(5)上述溶液中加入两倍体积的预冷无水乙醇,混合摇匀,放置10min。4℃下离心,5000r/min , 5min, 弃去上清液,并将Eppendorf管倒置在干滤纸上,空干管壁粘附的溶液。
(6)加入1mL 70%冷乙醇,洗涤沉淀物,离心,弃去上清液,尽可能除净管壁上的液珠,放置干燥或真空干燥,即得质粒DNA制品。
(7)将DNA沉淀溶于50μlTE缓冲液(临用前加入20μg/mLRNaseA),置-20℃保存,备用