-
1 内容
-
2 练习
内容
单细胞微生物群体生长规律
生长曲线:在不补充营养或不移去培养物,保持整个培养液体积不变的情况下,以时间为横坐标,以菌数为纵坐标,根据不同培养时间里细菌数量的变化,可以作出一条反映细菌在整个培养期间菌数变化规律的曲线。
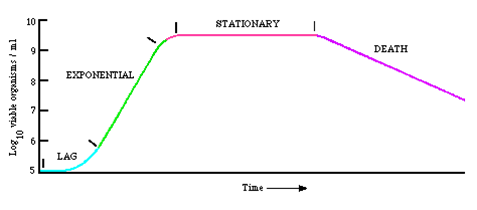
典型的生长曲线至少可以分为迟缓期、对数期、稳定期、衰亡期四个时期。

迟缓期:当细菌被接种到新鲜培养基而处于一个新的生长环境,开始一段时间内,通常不立即进行细胞分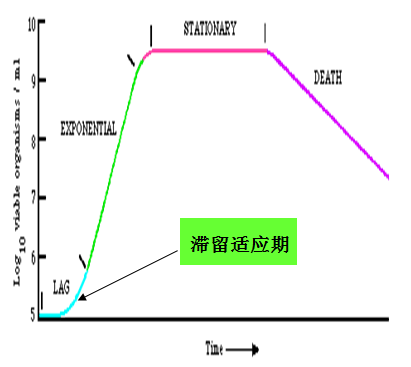 裂、增殖,生长速率近于零,细菌的数目几乎保持不变,甚至稍有减少,此时细胞内的RNA、蛋白质等物质含量有所增加,相对地此时细胞的体积最大,说明细胞并不是处于完全静止的状态,这段
裂、增殖,生长速率近于零,细菌的数目几乎保持不变,甚至稍有减少,此时细胞内的RNA、蛋白质等物质含量有所增加,相对地此时细胞的体积最大,说明细胞并不是处于完全静止的状态,这段
时间被称为迟缓期。
迟缓期是细胞分裂启动之前的恢复或调整期,而不是生长的休眠或停留期。迟缓期细胞的主要特征是代谢活跃,体积增大,从介质中快速吸收各种营养物质,大量合成细胞分裂所需的酶类、ATP和其他细胞组分,为细胞分裂准备。
迟缓期形成的原因:
细菌接种到一个新的环境,暂时缺乏足够的能量和必需的生长因子,需要调整代谢,需要合成必需的酶、辅酶或某些中间代谢产物,“种子”老化(即处于非对数生长期)或未充分活化,接种时造成的损伤等均可造成迟缓期的出现。此期的长短与营养成分、菌种遗传特性、菌令和接种量等因素有关。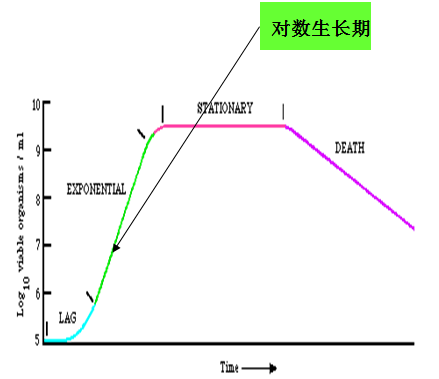
对数期:一旦细菌细胞的生理修复或调整完成,迟缓期即告结束,细胞开始进入快速分裂阶段。由于这一时期细胞数目的增加以几何级数进行,故称对数期。对数期的细胞分裂速度最快、代时最短、代谢活动旺盛、酶活性高、对环境变化敏感,细胞大小比较一致,并且细胞内的核糖体等组分也像细胞数目一样以同样的对数生长速率增加,细胞合成核糖体以及蛋白质越多,其生长速率也越快。因而对数期的细菌通常被广泛地用于生产上的“种子”,并在科研上作为理想的实验材料。
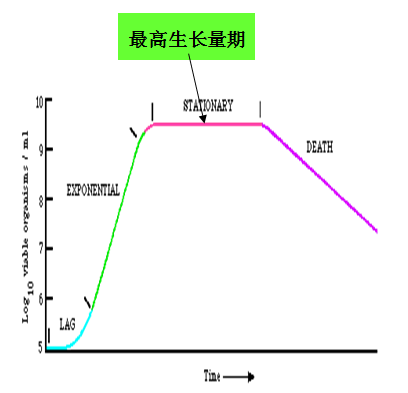 稳定期:在一个封闭的系统(一次性培养,分批培养)中,细菌的对数生长期只能维持一个短暂的时期,最终生长速度将会降低,代时延长,细胞活力减退,进入了稳定期。在稳定期中,新生的细胞数目与死亡的细胞数目相等,总菌数达到最大值,活菌数保持恒定。
稳定期:在一个封闭的系统(一次性培养,分批培养)中,细菌的对数生长期只能维持一个短暂的时期,最终生长速度将会降低,代时延长,细胞活力减退,进入了稳定期。在稳定期中,新生的细胞数目与死亡的细胞数目相等,总菌数达到最大值,活菌数保持恒定。
稳定期形成的原因:
随着细菌细胞的生长和数目的增加,培养基中的营养被逐渐消耗而不能满足生长需要,代谢过程中产生的废物甚至有害物质积累达到了抑制生长的水平,氧气消耗导致了厌氧环境的出现。
稳定期细胞的特征:细胞从生理上的年轻转化为衰老,代谢活力钝化,细胞含有较少的核糖体,RNA和蛋白质合成缓慢,mRNA的水平低下,因此细胞的生长变得不平衡,细胞的形状有的也发生改变。因不能维持细胞壁的合成与修复,细胞的染色特点也发生改变,如G+转变为G- ,但此时细胞的许多功能,如能量代谢和某些生物合成过程还在继续进行,某些代谢产物特别是次生代谢产物主要就是在稳定期,特别是在对数期与稳定期转换阶段所产生的,这些产物包括抗生素和某些酶,某些细菌的芽孢产生也发生在稳定期。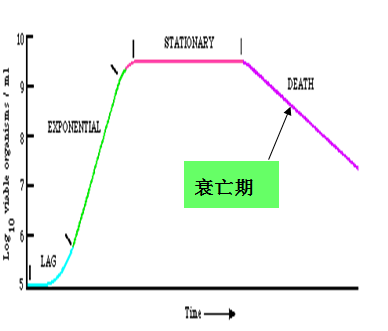
衰亡期:如果处于稳定期的细菌继续培养,由于营养物质的耗尽和有毒代谢产物的积累,细胞的死亡率将逐渐增加,最终群体中活的细胞数目将以对数速率急剧下降,此阶段便是衰亡期。此期细菌代谢活性降低,伴随着细菌细胞裂解或自溶可释放出一些代谢产物,如氨基酸、转化酶、外肽酶或抗生素等。菌体细胞呈现多种形态,有时产生畸形,细胞大小悬殊,有的细胞内含很多空泡,G+染色反应转变成G-染色反应。
生长曲线各时期的特征

生长曲线的意义:
◆ 处于对数期的细菌,生长繁殖速率快,代谢旺盛,常作生产用菌种,以缩短生产周期
◆ 稳定期时抗生素等代谢产物逐渐增多,适当补充营养物质,延长稳定期、可提高代谢产物的产量
◆ 连续培养:在一个流动装置中,以一定速度不断地添加新的培养基,同时以同样速度不断放出老的培养基,以保证微生物对营养物质的需要,并排出部分有害代谢产物,使微生物保持较长时间的高速生长。
应用:酒精、丙酮、丁醇等产品的生产
优点:缩短了培养周期,提高了设备利用率,并且便于自动化管理
微生物的连续培养
连续培养:
在一个恒定容积的流动系统中培养微生物,一方面以一定速率不断地加入新的培养基,另一方面又以相同的速率流出培养物(菌体和代谢产物),以使培养系统中的细胞数量和营养状态保持恒定,即处于稳态。 连续培养类型:
恒化培养、恒浊培养

天然环境中的微生物生长
天然环境特点:
天然环境比人工条件常常要更复杂和更动态。
天然环境中微生物生长特点:
在自然环境中,微生物常常合成一些人工条件下生长时所不产生的结构,如细菌粘液层。因为微生物细胞能够感受自然环境中发现的各种化合物,其直接反应就是合成一些有用的结构和酶以便在特定的环境中生存生长。
大量研究揭示,自然环境条件下的细菌能够生长在复杂的群落中,表现出生长在试管中的纯培养微生物所不曾发生的某些现象。
活的但未能培养的微生物
很久以来,活的微生物被定义为能够活跃生长,形成菌落或引起液体培养基浑浊的微生物。
英国科学家J.R. Postgate 首次提出了活的但未能培养的微生物概念, 指出受自然界生境压力(或选择性实验室培养基压力)的微生物,对次生压力特别敏感。这样的次生压力作用能够产生活的微生物,但却不能够在通常用作培养它们的培养基中生长。据估计,目前仅有大约0.1%原核微生物能够人工培养。
案例
用比浊法测定细菌的生长曲线
少量的细菌,接种到一定体积的、合适的新鲜液体培养基中,在适宜的条件下进行培养,定时测定培养液中的菌量,以菌量的对数作纵坐标、生长时间作横坐标,绘制的曲线为生长曲线。一般生长曲线可分为延迟期、对数期、稳定期和衰亡期,生长曲线是微生物在一定环境条件下于液体培养时所表现出的群体生长规律。不同的微生物其生长曲线不同,即使是同一种微生物,在不同的培养条件其生长曲线也不同,测定在一定条件下培养的微生物的生长曲线。在科学研究及生产上是非常有意义的。
准备:大肠杆菌,牛肉膏蛋白胨培养液,光电比色计或分光光度计,试管,三角瓶等
方法:
1)预先将大肠杆菌接种到肉膏蛋白胨培养液中,37℃振荡培养18h备用。
2)把光电比色计的波长调至420 nm,开机预热10-15min。
3)以未接种的肉膏蛋白胨培养液校正比色计的零点(以后每次测定都要重新校正零点)。
4)取盛有150 mL无菌肉膏蛋白胨培养液的500 mL锥形瓶6个,分为两组,分别编号为1、2、3号和4、5、6号。各瓶加入培养18h的大肠杆菌培养液10 mL,37℃下振荡培养。
5)于接种后的第0、2、4、6、8、10、12、14、16、18、20 h,分别用无菌移液管从各瓶中吸取培养液5mL,在光电比色计上测定OD420值。若菌液太浓时,作适当稀释,使OD420值在0.0-0.4之间较好。经稀释后测得OD420值要乘以稀释倍数,才是培养液实际的OD420值。
6)于培养第8h取样测定后,向其中一组(1-3号)每瓶加入肉膏胨培养液的5倍浓缩液10 mL作补料;另一组(4-6号)每瓶加入10 mL无菌水。继续振荡培养和定时测定。